
09 maj Charakter tlenków i wodorotlenków żelaza – co pisać na maturze?
Spójrzmy co wymaga się od maturzystów w 2022 roku:
opisuje typowe właściwości chemiczne tlenków pierwiastków m. i. Cr, Mn, Fe, Cu, Zn, w tym zachowanie wobec wody, kwasów i zasad (bez tlenku glinu); zapisuje odpowiednie równania reakcji. Tlenek glinu jest wymieniony w innym punkcie podstawy programowej, więc nie należy myśleć, że „Al2O3 nas nie obowiązuje”.
Charakter chemiczny tlenków i wodorotlenków żelaza to temat szczególny dla maturzystów i nauczycieli i ciągła zagwozdka – co pisać na maturze? Temat jest kontrowersyjny, tradycyjnie, z powodu rozbieżności informacji w podręcznikach szkolnych. Musimy zdawać sobie sprawę, że nie wszystkie informacje w podręcznikach szkolnych są prawdziwe – łącznie z opisami doświadczeń. Część z tych rozbieżności wynika z nieprawidłowej interpretacji tekstu w podręcznikach akademickich, z których korzystali autorzy podręczników szkolnych. Obecna matura z chemii jest nastawiona na zweryfikowane informacje, dlatego pewne zagadnienia, które pojawiały się jeszcze kilka lat temu, nie pojawiają się już wcale, albo pojawiają się w poprawionej wersji. Co więc pisać na maturze? Która wersja jest prawidłowa?
Zdający musi umieć projektować i przeprowadzać doświadczenia pozwalające otrzymać różnymi metodami kwasy, wodorotlenki i sole w roztworach wodnych (środowisku wodnym) i zapisywać odpowiednie równania reakcji. W tym celu zdający musi umieć posługiwać się tabelą rozpuszczalności do określania kierunku reakcji pomiędzy roztworami wodnymi soli albo soli z zasadą (roztworem wodorotlenku). A więc musi wiedzieć, że dany wodorotlenek wytrąci się jako osad, a następnie potwierdzić charakter wytrąconego wodorotlenku dodając nadmiaru zasady (tego samego wodnego roztworu, który dodał w celu strącenia), lub traktując go roztworem kwasu. W reakcjach analizy jakościowej, a więc również w reakcjach strąceniowych, o których mówi tabela rozpuszczalności stosuje się roztwory o stężeniach 0,1 – 2 mol/dm3. Reakcje te przeprowadza się więc w wodnym środowisku – cząsteczki i jony substancji rozpuszczonych są otoczone cząsteczkami wody.
Wodorotlenki dzielimy zwykle w szkole na zasadowe i amfoteryczne. Amfoteryczność oznacza, że związek ma dwojaki charakter: zarówno kwasu, jak i zasady. Właściwości zarówno pierwiastków, jak i ich związków zmieniają się stopniowo – nie ma ostrego przeskoku od zasadowości do kwasowości – charakter chemiczny zmienia się stopniowo – stopniowo rośnie udział charakteru kwasowego.
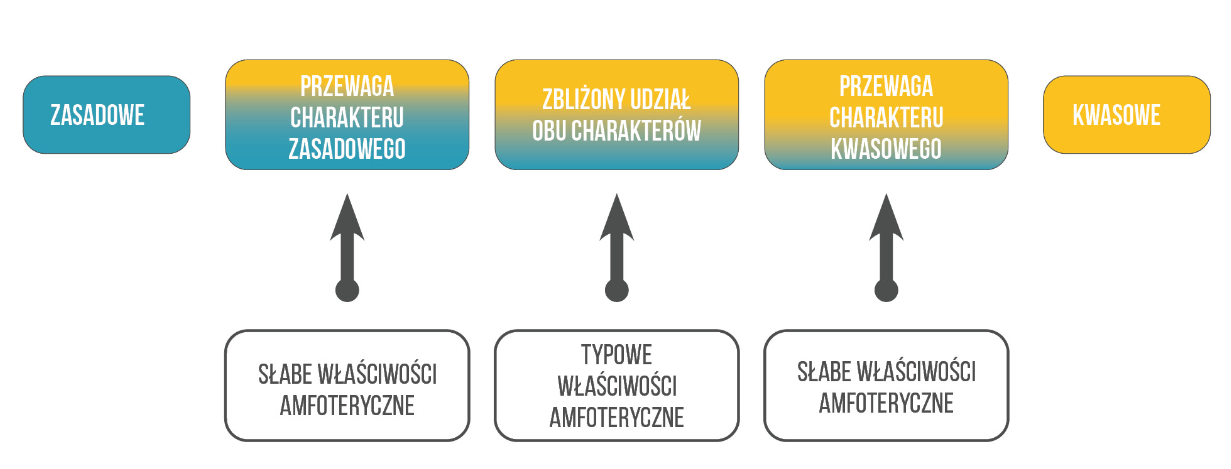
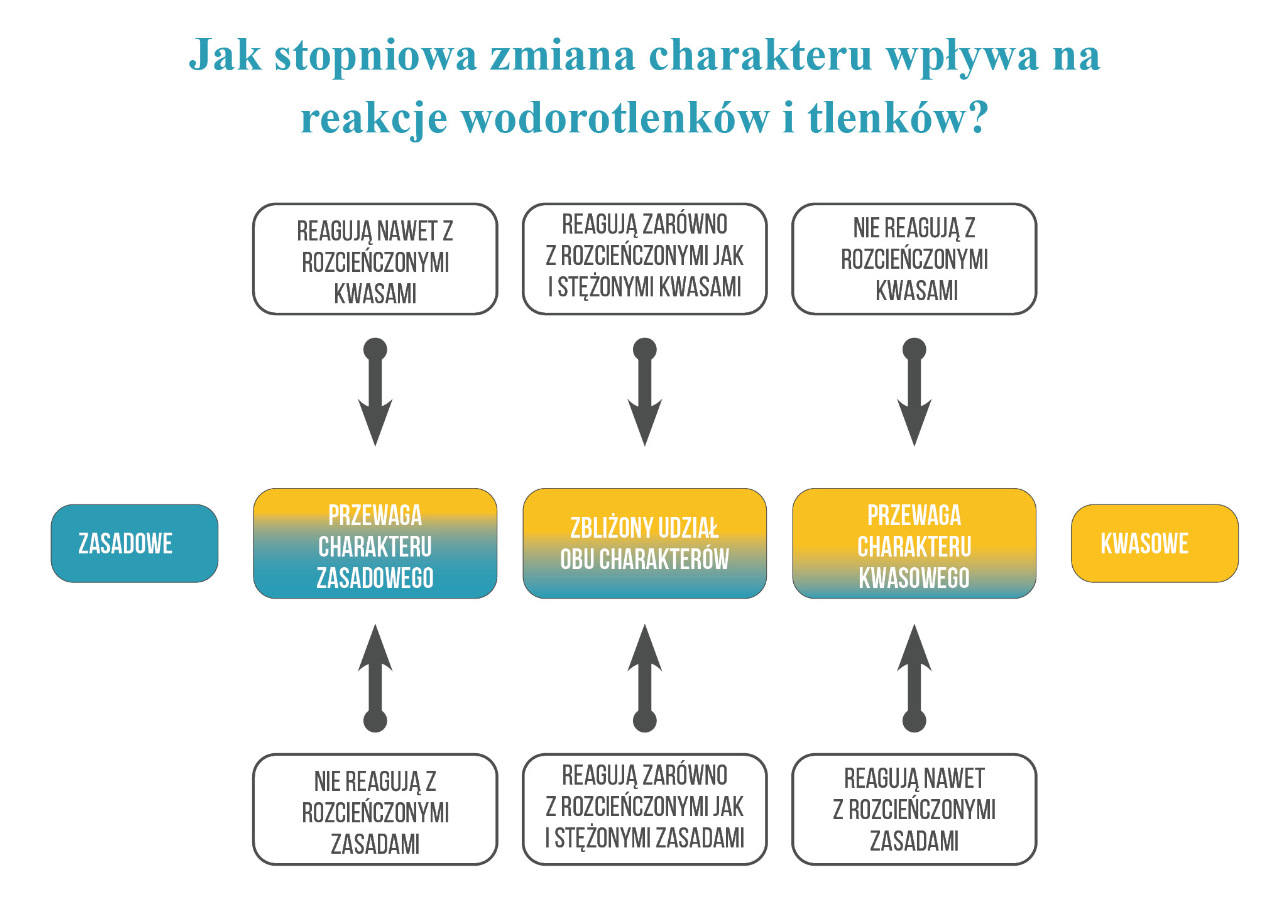
Charakter chemiczny to nie jest pojęcie bezwzględne i zależy także od środowiska, w którym dana substancja się znajdzie. Wśród wodorotlenków istnieją związki, które mają bardzo słaby kwasowy charakter, a silnie zasadowy – właściwości takich związków zależą od środowiska, w którym się znajdą.
Przez środowisko rozumiemy otoczenie drobin danej substancji. W rozcieńczonych wodnych roztworach najbliższe otoczenie danej drobiny danej substancji (cząsteczki lub jonu) stanowią cząsteczki wody. Ale w stężonych wodnych roztworach otoczenie danego jonu lub cząsteczki oprócz cząsteczek wody otoczenie stanowią także inne drobiny (cząsteczki, jony lub zarówno jony jak i cząsteczki tej samej substancji). No w rozcieńczonej zasadzie sodowej – roztworze NaOH w wodzie o stężeniu np. 0,2 mol/dm3 najbliższe otoczenie jonów Na+ stanowią cząsteczki wody. Analogicznie jony OH– są otoczone cząsteczkami wody. Ale w roztworze o stężeniu stukrotnie większym (20 mol/dm3) jony są otoczone nie tylko cząsteczkami wody, ale także innymi jonami pochodzącymi z NaOH – środowisko stanowi nie tylko rozpuszczalnik, ale także sama substancja rozpuszczona. To nie jest środowisko wodne – znacznie zwiększając stężenie zmieniliśmy środowisko, w którym znajduje się dana substancja.
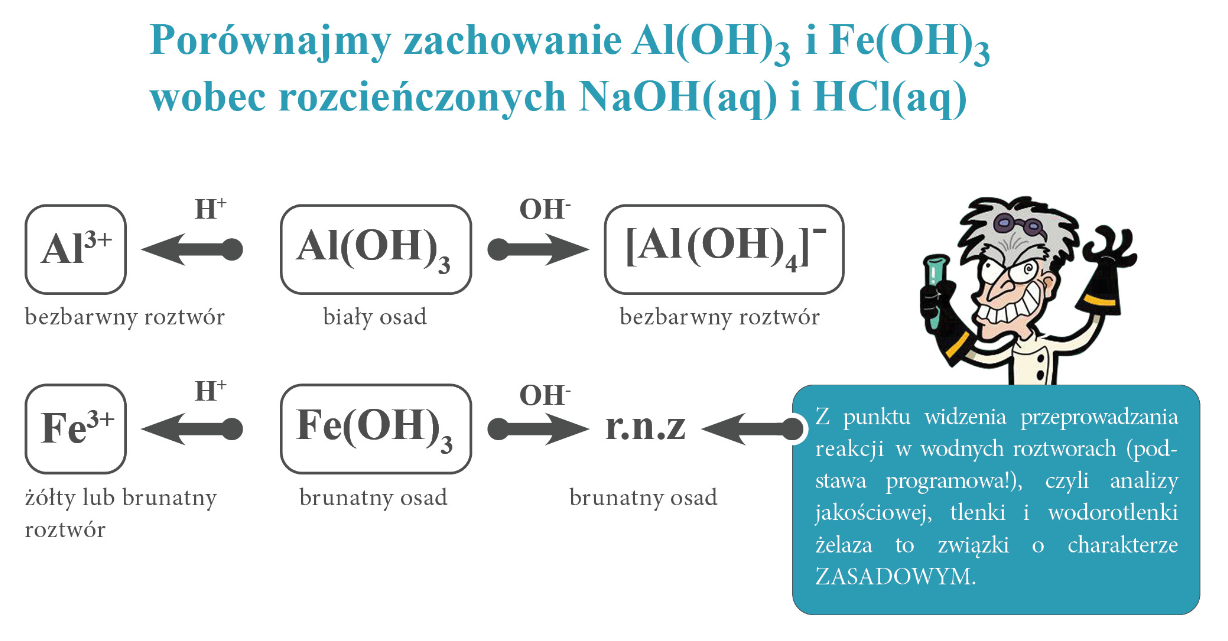
Z punktu widzenia przeprowadzania reakcji w wodnych roztworach, czyli wodnym środowisku(!) (podstawa programowa!), jak czyni się podczas analizy jakościowej, to tlenki i wodorotlenki żelaza to związki o charakterze ZASADOWYM. Tlenki i wodorotlenki żelaza kwasowe właściwości mają dopiero w stężonych zasadach – roztwarzają się wtedy nieznacznie, czyli niewielkie ilości osadu roztwarzają się w dużym nadmiarze zasady. Stężone kwasy i zasady to nie środowisko wodne. Reakcje takie przeprowadza się zwykle na gorąco, wymagają długiego czasu i są przeprowadzane w aparaturze odpornej na stężone zasady (np. wykonanej ze srebra). Związki takie zwiemy słabo amfoterycznymi, ale zwróć uwagę na to, że słabo amfoteryczne nie oznacza, że zachowuje się samo jak typowy związek amfoteryczny.Posługując się „probówką maturalną” (reakcje w roztworach wodnych) stwierdzamy, że mają zasadowy charakter.
Hydroksokompleksy żelaza, wydzielone z roztworu poreakcyjnego, w kontakcie z wodą rozpadają się na Fe(OH)2/Fe(OH)3 i NaOH/KOH – powstaje więc osad wodorotlenku żelaza i odpowiednia zasada nad nim. To samo zaobserwujemy po rozcieńczeniu roztworu poreakcyjnego. Czy domyślasz się dlaczego? Bo wodorotlenki żelaza w wodzie (wodnym środowisku) mają zasadowy charakter, a to oznacza, że hydroksokompleksy żelaza nie mogą istnieć w wodnym środowisku – dlatego wprowadzone do wody rozkładają się na odpowiednie wodorotlenki. Skoro Fe(OH)3 nie reaguje z rozcieńczonym NaOHaq, to hydroksokompleks wprowadzony do wody rozpadnie się na te związki. Dzięki temu, że
Ponieważ wobec rozcieńczonych zasad tlenki i wodorotlenki żelaza mają odmienny charakter niż Al(OH)3 i Al2O3, to związki żelaza i glinu można rozdzielić od siebie zasadą sodową. Proces ten stosuje się w produkcji glinu. Boksyt jest mieszaniną tlenków i wodorotlenków glinu i żelaza. Aby wyodrębnić glin boksyt poddawany jest działaniu zasady sodowej, która roztwarza związki glinu, ale nie roztwarza związków żelaza (proces Bayera). Produktem odpadowym jest tzw. czerwony szlam – mieszanina o zasadowym odczynie, zawierająca głównie czerwony Fe2O3. Co więcej, to ze względu na odporność tlenków i wodorotlenków żelaza na zasady, to w zasadowym środowisku żelazo jest praktycznie odporne na korozję – pokrywa się warstewką wodorotlenków i tlenków żelaza, czyli ulega pasywacji. Dzięki temu pręty zbrojeniowe w betonie są odporne na korozję zarówno podczas twardnienia betonu, jak i podczas jego użytkowania. Wodorotlenek wapnia obecny w zaprawach cementowych nadaje odpowiednio wysokie pH do pasywacji żelaza. Dopiero gdy czynniki zewnętrzne, np. długotrwale przeciekająca przez beton woda spowoduje wypłukanie części składników i obniżenie pH – dopiero wtedy żelazo traci pasywność i rozpoczyna się korozja prętów zbrojeniowych, która może doprowadzić do katastrofy budowlanej.
Do tej samej grupy należą związków co tlenki i wodorotlenki żelaza należą też CuO i Cu(OH)2 – Cu(OH)2 roztwarza się częściowo, ale dopiero wobec stężonych zasad, dając hydroksokomplesy nadające roztworowi intensywnie niebieski kolor. Ale rozcieńczenie roztworu powoduje strącenie się Cu(OH)2. Dlatego też w próbie Trommera pomimo nadmiaru zasady, mamy osad Cu(OH)2, a nie intensywnie niebieski roztwór hydroksokompleksu. Oczywiście przy braku alkoholi polihydroksylowych, które roztwarzają Cu(OH)2 i dają kompleksy o podobnej barwie. Paradoksem edukacyjnym jest, że do tej samej grupy należą MgO i Mg(OH)2 – częściowo roztwarzają się w stężonych zasadach, można wydzielić krystaliczny Na2[Mg(OH)4]. Co ciekawe, to związki te łatwiej roztworzyć w stężonych zasadach, niż kontrowersyjne związki żelaza. A jednak podręczniki szkolne milczą na temat jego słabej amfoteryczności i zaliczają te związki do zasadowych. Nie ma żadnych kontrowersji wokół Mg(OH)2 w podręcznikach. Tylko zerojedynkowo: zasadowy. Na podstawie czego? Na podstawie jego zachowania wobec OH– w środowisku wodnym. Czyli w probówce maturalnej. Czyli da się? Da się. To w przypadku związków żelaza też się zapewne da, zwłaszcza, że maturzysta ma umieć zbadać charakter w probówce, a nie stapiając coś z NaOH w srebrnej parownicy nad palnikiem i potem jeszcze sprawdzając, czy substraty na pewno przereagowały – w tym przypadku trudno będzie zauważyć zanik osadu, jak to ma miejsce w probówce.
Wróćmy do egzaminu maturalnego.W całej jego historii tlenki i wodorotlenki żelaza pojawiły się 4 razy, a są to: dwa razy bilansowanie reakcji redoks, jedno zadanie z obliczeń stechiometrycznych, jedno zadanie, w którym trzeba zapisać równanie reakcji na podstawie informacji o produktach. CZYLI JAK DOTĄD BRAK ZADAŃ Z PYTANIAMI O CHARAKTER POWYŻSZYCH, NAWET Z INFORMACJĄ WSTĘPNĄ! NIE MOŻNA NAWET SPRAWDZIĆ, CO BYŁO W „STARYCH KLUCZACH” BO PO TAKIEGO ZADANIA NA MATURZE NIE BYŁO.
Czy więc jest się czego bać? Nie. Matura nie sprawdza, czy nauczyłaś/eś się charakteru związków na pamięć. To i tak by zależało od podręcznika, z którego korzystasz, a w przypadku kilku podręczników – sami wiemy co… A ponieważ matura nie sprawdza, czy nauczyłeś się np. charakteru tlenków na pamięć, to dlatego matura nie ma formy testu wyboru. Matura sprawdza, czy rozumiesz, czy potrafisz wykorzystać wiedzę, czy potrafisz wskazać związek, czy potrafisz wyciągnąć wniosek. Dlatego istotne jest, by wiedzieć czym się charakteryzują związki o poszczególnym charakterze, jak sprawdzić lub potwierdzić charakter doświadczalnie, lub by wyciągnąć wniosek na podstawie tekstu źródłowego lub z przeprowadzonego doświadczenia. Dlatego zadanie dotyczące charakteru wodorotlenku niklu miało taką budowę:

No wiec jeszcze raz: czy to znaczy, że aby odpowiedzieć prawidłowo należało się nauczyć charakteru Ni(OH)2 na pamięć?
Odpowiadając na liczne pytania nauczycieli: „A jak uczyć do matury”? Zawsze uczyć dobrze. Uświadamiać, że świat nie jest zerojedynkowy – tłumaczyć, z czym dane pojęcie się wiąże. I uświadamiać, że nie wszystkie informacje z podręczników szkolnych są wiarygodne, że nie wszystkie zadania ze zbiorów miały wcześniej doświadczalne potwierdzenie, a arkusze z „próbnych matur” wydawnictw nie były weryfikowane przez jednostki egzaminacyjne.



Brak komentarzy