
18 paź Kłopotliwa reakcja chromu z kwasami
Do napisania tego artykułu skłoniło mnie pytanie, które dostałem od uczennicy w związku z rozbieżnością odpowiedzi. Dość ciekawym podręcznikowym przypadkiem jest roztwarzanie chromu w kwasie solnym lub siarkowym bez dostępu tlenu, oraz przy dostępnie tlenu.
Spójrzmy na równania poniżej.
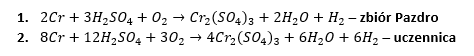
Można dojść do jeszcze innych równań:
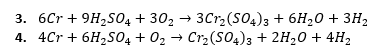
Można założyć, że tlen jest jedynym utleniaczem, a H2SO4 zapewnia środowisko reakcji:
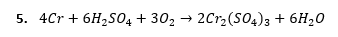
We wszystkich przypadkach otrzymaliśmy równania reakcji chemicznej, a to oznacza, ze jest ustalony bilans materiałowy, jak i elektronowy – można samemu sprawdzić. Czy oznacza to, że proces roztwarzania chromu przy dostępie powietrza jest skomplikowany i niestechiometryczny? Czy to znaczy, że jest to kombinacja możliwości opisanych wieloma równaniami stechiometrycznymi zachodzącymi równolegle i nie można określić, ile konkretnie tlenu potrzeba i ile wodoru się wydzieli? Niekoniecznie.
Zastanówmy się: po co jest tlen w tym układzie? Bez dostępu powietrza reakcja roztwarzanie chromu w kwasie siarkowym opisana jest równaniem stechiometrycznym:
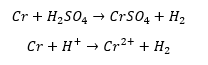
Z kolei tlen utlenia jony Cr2+ do Cr3+ w kwasowym środowisku:
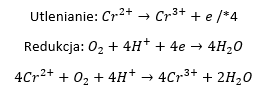
Mamy więc układ reakcji następczych: roztwarzania chromu w jednej i utleniania Cr(II) do Cr(III) w drugiej. Jak je zbilansować? Jedna cząsteczka tlenu utlenia 4 kationy Cr2+. Aby wytworzyć 4 kationy Cr2+ potrzebujemy roztworzyć 4 atomy metalicznego Cr.
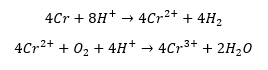
Po zsumowaniu obu równań:
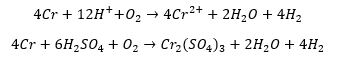
Ze względu na to, że są to dwie reakcje następujące po sobie niezależnie, to z powodów kinetycznych nie otrzymamy soli Cr(III) jako jedynej soli. Kwas siarkowy niezbędny w drugiej reakcji zużywa się także w pierwszej. Jeśli roztwarzanie chromu przebiega szybciej, niż następcze utlenianie (a ze względu na konieczność dyfuzji słabo rozpuszczalnego tlenu do środowiska reakcji tak zapewne jest), to w produktach otrzymamy najpierw głównie sól Cr(II), która stopniowo pod wpływem dyfundującego tlenu przechodzi w sól Cr(III). Sumarycznie więc, bilans zamknie się dopiero po utlenieniu Cr(II) do Cr(III). Jeśli zakwasimy r-r CrSO4 i pozostawimy w kontakcie z powietrzem, to tlen utleni nam jony Cr2+, co potwierdza ścieżkę reakcji wspomnianą wyżej. Analogicznie jest w przypadku roztwarzania metalicznego żelaza w H2SO4 lub HCl, gdzie także przy dostępnie powietrza podczas roztwarzania powstaje pewna ilość soli Fe(III) wskutek następczego utleniania w środowisku kwasowym, które pojawia się już podczas roztwarzania metalu, jeśli powietrze ma szansę dyfundować do układu. Jeśli po roztworzeniu żelaza w nadmiarze kwasu pozostawimy roztwór w kontakcie z powietrzem, to po czasie otrzymamy r-r soli Fe(III), a nie Fe(II). Niestety brak odpowiednich podstaw elektrochemii w programie, ale także brak odpowiednich komentarzy w podręcznikach skutkuje tym, że uczniowie, a nawet część nauczycieli, będą mieć zagwozdkę, który bilans jest dobry w sytuacji, gdy przez przypadek otrzymają inny wynik niż w podręczniku lub w odpowiedziach w zbiorze, ale prawidłowo uzgodniony (L=P). W takich sytuacjach należałoby uznać wszystkie za poprawne. W zbiorze Pazdro bilans elektronowy wygląda następująco:
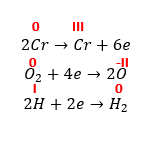
Po prostu autor założył, że część elektronów redukuje cząsteczkę tlenu, a pozostałe – kationy wodoru. Ale to błędne założenie ze względu na molekularny aspekt zachodzenia reakcji, gdzie rządzi rachunek prawdopodobieństwa. Nawet gdyby chrom utleniał się bezpośrednio do Cr3+ – redukcja tlenu i kationów wodoru zachodziłaby niezależnie od siebie, a więc w trudnym do określania stosunku, ale biorąc pod uwagę ograniczony dostęp tlenu – dominowałoby wydzielanie wodoru. Tutaj autor uzależnił ilość wydzielonego wodoru od tlenu, zakładając z góry liczbę elektronów i oraz określony podział tej liczby pomiędzy dwa reduktory.



Brak komentarzy