01 paź Niektóre kłopotliwe przypadki ze stopniami utlenienia
Czy wiemy jaki stopień utlenienia przypisujemy atomowi azotu w cząsteczce HNO3? Prawdopodobnie z automatu odpowiemy, że V, bo to w końcu kwas azotowy(V), gdzie liczba w nawiasie oznacza stopień utlenienia azotu (nie wartościowość!). I słusznie. Pochodnymi tego kwasu są sole i estry – azotany(V). Mają one budowę jonową lub kowalencyjną – w tym pierwszym przypadku zawierają jon NO3–:
Sole można otrzymać w reakcji zobojętniania, np:
Ca(OH)2 + 2HNO3 → Ca(NO3)2 + 2H2O
I tutaj stopień utlenienia azotu także wynosi V, lub inaczej mówiąc: przypisujemy mu piąty stopień utlenienia.Podobnie w przypadku estrów, np, azotanu metylu CH3NO3 – tutaj także nie zmienia się stopień utlenienia. Ale kwas azotowy bierze udział nie tylko w reakcjach zobojętniania czy estryfikacji – bierze także udział w reakcji nitrowania. I tak z benzenu w reakcji z mieszaniną nitrującą (st. HNO3 + st. H2SO4) powstaje nitrobenzen C6H5NO2.
C6H6 + HNO3 → C6H5NO2 + H2O
A nitrobenzen jest redukowany wodorem lub innym reduktorem do aniliny C6H5NH2. Spróbujmy zapisać schemat reakcji:
C6H5NO2 + H2 → C6H5NH2 + H2O
Aby uczynić z tego równanie należy to jeszcze zbilansować. I tutaj często zaczyna się problem. Trzeba przypisać stopnie utlenienia atomowi azotu przed i po reakcji, by ustalić liczbę wymienianych elektronów. Ok, przecież grupa nitrowa pochodzi od kwasu azotowego(V), to znaczy, że w nitrobenzenie też będzie V – mówi wiele osób zasiadając do tego zadania. A anilina to jak amoniak, więc -III. Z kolei wodór przechodzi z zerowego na I. Spróbujmy więc wykonać bilansowanie:
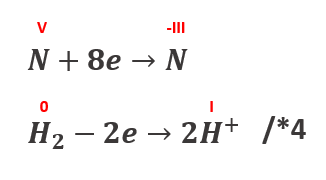
A zatem otrzymamy współczynniki:
C6H5NO2 + 4H2 → C6H5NH2 + 3H2O
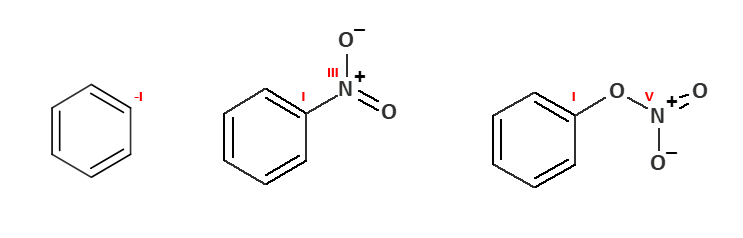
I tak zamiast równania mamy nierówność – albo nie będzie się zgadzała liczba atomów tlenu, albo wodoru. Skąd to wynika? Zastanówmy się, czym się kierowaliśmy, sądząc, że atomowi azotu należy przypisać V? Bo założyliśmy, że podczas nitrowania stopnie utlenienia nie ulegają zmianie. Ale jednak atom azotu zmienił swoje otoczenie – zamiast jednego atomu tlenu – wiąże się teraz z atomem węgla. To zmienia sytuację, bowiem przypisując stopnie utlenienia posługujemy się skalą elektroujemności Paulinga, zakładając, że pierwiastek bardziej elektroujemny zabiera elektrony z wiążącej pary. Atom azotu straciłby 4 elektrony na rzecz tlenu, ale zyskałby jedną od atomu węgla. nitrobenzen to nie azotan fenylu C6H5NO3, gdzie pomiędzy atomem węgla i azotu jest mostek tlenowy. To nitrozwiązek – inna klasa związków. Nitrobenzen nie jest pochodną kwasu azotowego – bo nie jest ani estrem, ani solą – nie powstał przez podstawienie atomu wodoru w kwasie. Jest za to pochodną benzenu – powstał przez podstawienie atomu wodoru w pierścieniu aromatycznym. Porównajmy wzory benzenu, nitrobenzenu i azotanu(V) fenylu i stopnie utlenienia:

A zatem pod drobnej korekcie stopni utlenienia zbilansujmy jeszcze raz:
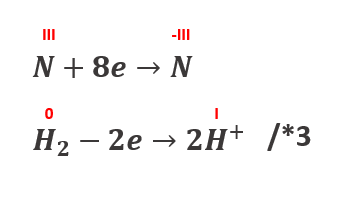
C6H5NO2 + 3H2 → C6H5NH2+2H2O
Jeśli kogoś nie przekonuje, że atomowi azotu w nitrozwiązkach należy przypisać III stopień utlenienia, to zobaczmy, że nitrozwiązki można otrzymać także inną drogą: w reakcji substytucji nukleofilowej:
CH3Cl+NaNO2 → CH3NO2 + NaCl
A przecież w NaNO2 atomowi przypiszemy III stopień utlenienia. Grupa nitrowa jest izomeryczna z grupą azotanową (III). Otrzymaliśmy nitrometan używając związku azotu(III), a nie azotu(V). Tymczasem nie zawsze zdajemy sobie z tego sprawę, ale nitrowanie (czyli reakcja z zastosowaniem mieszaniny nitrującej) i inne reakcje substytucji elektrofilowej – są reakcjami redoks.
Tymczasem dla redukcji nitrobenzenu do aniliny metodą bilansowania jonowo-elektronowego otrzymamy równania połówkowe zupełnie nie mielibyśmy tego problemu wygenerowany przez błędnie przypisany stopień utlenienia, bo tam bilans uzgadnia się inaczej :
Redukcja: C6H5NO2 + 6H+ +6e → C6H5NH2 + 2H2O
Utlenianie: H2 → 2H++2e
I otrzymujemy:
C6H5NO2 + 3H2 → C6H5NH2+2H2O
Jeśli chcesz dokładnie zrozumieć chemię i bardzo dobrze przygotować się do matury to zapraszam na moje lekcje online. Podczas zajęć tłumaczę teorię i pokazuję jak prawidłowo rozwiązywać zadania. Dodatkowo dzielę się bardzo cennymi materiałami. Szczegóły znajdziesz TUTAJ.




Brak komentarzy