
19 gru Autodysocjacja wody a pH, czyli jak NIE należy liczyć pH
Gdyby nas zapytać, jakie pH ma roztwór KOH o stężeniu 0,1 mol/dm3, to chyba nie ma osoby, która by powiedziała inaczej niż 13. Oczywiście mam tutaj na myśli temperaturę 25 °C. Wtedy iloczyn jonowy wody wynosi 10-14, a pKw=14. Jak dojść do pH równego 13? Korzystamy z zasady, że pKw = pH + pOH. A zatem:
pOH = -log100,1 = 1
pH = 14 – 1 = 13
I wszystko jest jasne i klarowne.
Ale rozpatrzmy teraz kwas solny o różnych stężeniach:
| CHCl, mol/dm3 | pH |
| 0,1 | 1 |
| 0,01 | 2 |
| 0,001 | 3 |
| 0,0001 | 4 |
I to jest zgodne z tym, czego oczekujemy. Dziesięciokrotne rozcieńczenie mocnego kwasu podnosi pH roztworu o 1. Sytuacja komplikuje się, gdy rozcieńczamy roztwór bardziej. Zastanówmy się: jakie będzie pH kwasu solnego rozcieńczonego do stężenia 0,0000001 mol/dm3 (tj. 10-7 mol/dm3) albo do stężenia 0,00000001 mol/dm3 (tj. 10-8 mol/dm3)? Oczywiście idąc tokiem postępowania, że stężenie kationów wodoru jest równe stężeniu kwasu:
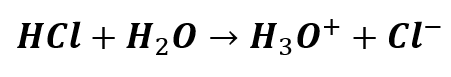
Dojdziemy do kuriozalnej odpowiedzi, że pH wynosi 7 w jednym przypadku, a 8 w drugim. Ale, jak wspomniałem, wyniki te są kuriozalne. Kwas solny nie może mieć odczynu obojętnego ani tym bardziej zasadowego. I tutaj dochodzimy do sedna. Źródła kationów wodoru w wodnych roztworach chlorowodoru są dwa:
– dysocjacja kwasu solnego,
– autodysocjacja wody.
W czystej wodzie o temperaturze 25 °C stężenie kationów wodoru jest równe stężeniu jonów OH– i wynosi 0,0000001 mol/dm3 (tj. 10-7 mol/dm3).
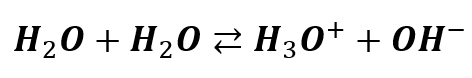 A zatem pH czystej wody wynosi 7, a odczyn jest obojętny.
A zatem pH czystej wody wynosi 7, a odczyn jest obojętny.
Ale wróćmy do kwasu solnego. Wiele osób twierdzi, że w tak mocno rozcieńczonych kwasach stężenie kationów wodoru powstałych w wyniku dysocjacji kwasu jest zbliżone do stężenia kationów wodoru powstałych w wyniku autodysocjacji wody. Takie stwierdzenie jest oczywiście prawdziwe.
Ale jak obliczyć pecha tak mocno rozcieńczonego kwasu solnego? A teraz to już bardzo ładnie proszę, żeby doczytać to do końca! Tylko wtedy mamy szansę I tutaj wiele osób twierdzi, że po prostu trzeba dodać stężenie kationów wodoru powstałych w wyniku dysocjacji kwasu oraz dysocjacji wody. Czyli stężenie H3O+ powiększyć o 10-7 mol/dm3. I tak w przypadku kwasu solnego o stężeniu 10-7 lub 10-8 mol/dm3 otrzymamy:
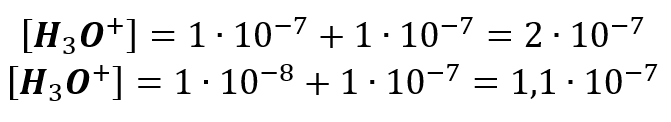
A to nas prowadzi do pH:
6,699 – dla kwasu solnego o stężeniu 10-7 mol/dm3,
6,959 – dla kwasu solnego o stężeniu 10-8 mol/dm3.
Dziesięciokrotne rozcieńczenie kwasu solnego o stężeniu 10-7 mol/dm3 nie powoduje wzrostu pH o 1. Jak często słyszymy, dopóki stężenie protonów wnoszonych przez dysocjacji kwasu jest wielokrotnie większe niż stężenie protonów tworzonych w wyniku dysocjacji wody (czyli 10-7 mol/dm3), to można je pominąć, bo i tak nie mają specjalnego wpływu na pH. Zresztą sprawdźmy na przykładzie HCl o stężeniu 0,0001 (tj. 10-4) mol/dm3.
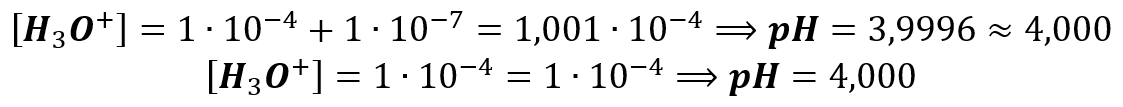
Czyli jest to ta sama liczba z dokładnością do 3 miejsc po przecinku. No i takie same informacje znajdujemy np. w podręcznikach czy innych źródłach szkolnych, np. tutaj:

Tak samo powtarza wielu nauczycieli. Powtarza to, co widzimy wyżej i tak samo tłumaczą to sobie uczniowie.
Tak się składa, że wszyscy autorzy szkolnych źródeł uparli się na kwas solny. Skala pH to nie tylko roztwory o odczynie kwasowym. To także roztwory substancji, które podnoszą stężenie jonów OH–. A zatem powtórzmy to samo dla roztworu KOH w wodzie o temperaturze 25 °C.
Obliczymy pH wodnych roztworów KOH o stężeniach 10-7 i 10-8 mol/dm3.
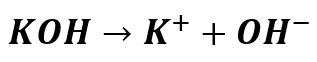
Jakie będą stężenia jonów OH–?
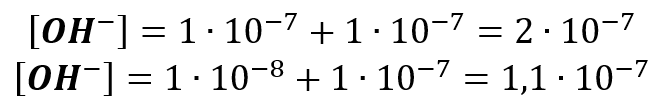
Postąpiliśmy tak samo jak poprzednio: po prostu uwzględniliśmy jony OH– powstałe w wyniku autodysocjacji wody.
Ale do obliczenia pH potrzebne jest nam stężenie jonów H3O+. O ile źródła jonów OH– są dwa, o tyle źródło jonów H3O+ jest jedno – autodysocjacja wody. Policzmy więc pH roztworu o stężeniu 10-8 mol/dm3:
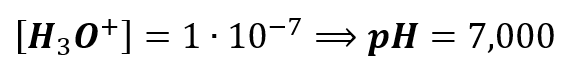
Ale dokładnie taki sam wynik otrzymamy, gdy policzymy pH roztworu o stężeniu 10-7 mol/dm3:
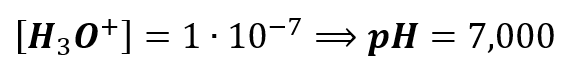
Bo w obu przypadkach jedynym źródłem kationów wodoru jest autodysocjacja wody.
Co więcej, to gdy policzymy pH roztworu KOH o stężeniu 10-6 mol/dm3:
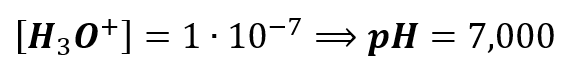
to otrzymujemy ten sam wynik zamiast spodziewanego pH 8! A przecież to jest ten sam tok postępowania co wcześniej: uwzględniamy autodysocjację wody! Czyli uwzględniliśmy, że stężenie H3O+ z autodysocjacji wody wynosi 10-7 mol/dm3.
Jak więc do tego doszło, że pH roztworów KOH nie zależy od stężenia KOH? Co więcej. To nawet w roztworze KOH o stężeniu 0,1 mol/dm3 otrzymamy wynik pH=7! A spodziewamy się 13…
Bo wszystko, co zaczęło się od tego zdania: „Czyli stężenie H3O+ powiększyć o 10-7 mol/dm3.” JEST NIEPRAWDĄ. Tak, ta opisywana przez podręczniki i vademeca/repetytoria sztuczka jest po prostu nieprawdą.
Ta powtarzana powszechnie informacja o tym, że trzeba dodać 10-7 z autodysocjacji wody NIE uwzględnia najważniejszej rzeczy. Że dysocjacja wody jest procesem odwracalnym:
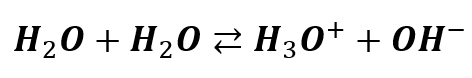
A przecież nawet od maturzysty wymaga się, by o tym wiedział! Nawet maturzysta ma wiedzieć, że iloczyn jonowy wody jest stałą równowagi! A jeśli tak, to działa tutaj reguła przekory. Tylko w czystej wodzie, powtarzam: w czystej wodzie o temperaturze 25 °C stężenie kationów wodoru wynosi 10-7 mol/dm3.
A przecież rozpuszczając w wodzie chlorowodór, który dysocjuje praktycznie nieodwracalnie – zwiększamy stężenie kationów wodoru…
A to oznacza, że stan równowagi autodysocjacji wody zostanie przesunięta w lewo. Zapominamy więc o tym, że w kwasie solnym o stężeniu 10-7 mol/dm3:
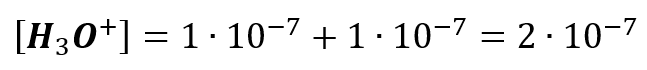
Zapominamy więc o powyższym zapisie. Bo nie jest prawdziwy! W rzeczywistości stężenie kationów wodoru jest niższe, bo kwas solny dysocjując wpłynął na stopień dysocjacji wody. Jak więc policzyć pH w kwasie solnym o takim stężeniu? Pozwolę sobie oznaczyć pewne rzeczy kolorami, żeby to lepiej zobrazować. W roztworze takim zachodzą procesy:
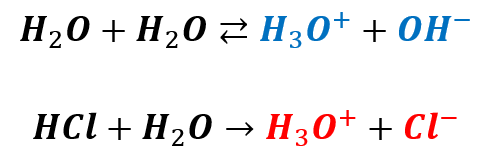
Jednocześnie wiemy, że:
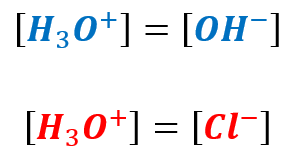
A ponieważ:
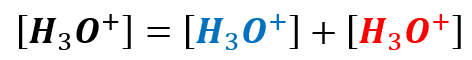
To jednocześnie:

Ale też wiemy, że stężenie anionów chlorkowych jest równe 10-7 mol/dm3.

Ponadto równowagę procesu autodysocjacji opisuje iloczyn jonowy wody, który w 20 °C wynosi 10-14:
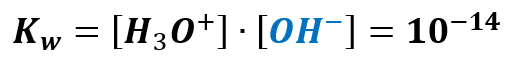
Podstawiamy zatem za stężenie H3O+ otrzymane wyrażenie:
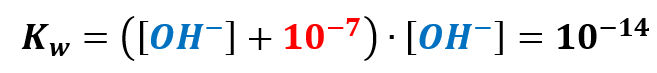
A dalej to już chyba możemy darować sobie kolory, ale je pozostawię:
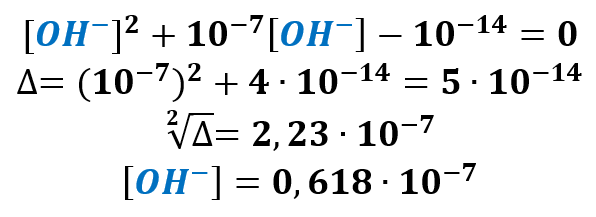
A teraz przypominamy sobie, że aniony OH– powstają wyłącznie w autodysocjacji wody. A zatem kationów wodoru powstałych w wyniku autodysocjacji wody. Jest tyle samo, co tych jonów ujemnych.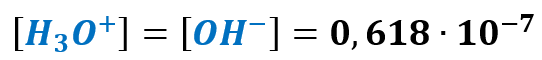
Jak widzimy wprowadzenie mocnego kwasu nawet w tak niewielkim stężeniu wpłynęło w zauważalnym stopniu na autodysocjację wody. Przystępujemy do obliczenia pH: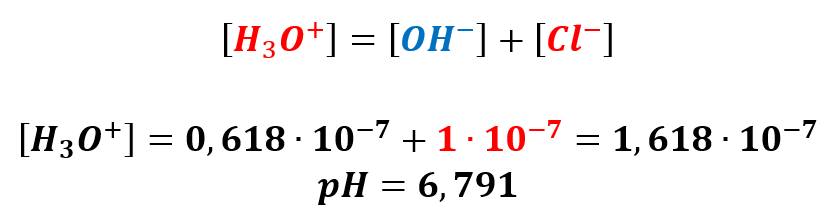
Przypomnę, że wcześniej otrzymaliśmy wyniki:
6,699 – dla kwasu solnego o stężeniu 10-7 mol/dm3,
6,959 – dla kwasu solnego o stężeniu 10-8 mol/dm3.
Teraz otrzymany wynik różni się więc o około 0,1. Jeśli więc ktoś twierdzi, że pH takiego kwasu solnego wynosi dokładnie 6,699, To nie podaje wyniku dokładnego, tylko zapisane do iluś cyfr po przecinku. Ale za to niezbyt bliski wartości dokładnej (prawdziwej).
A dla kwasu solnego o stężeniu 10-8 mol/dm3 otrzymany pH = 6,978. I ten wynik także się różni.
A wróćmy na chwilę do kwasu solnego o stężeniu 0,0001 mol/dm3:
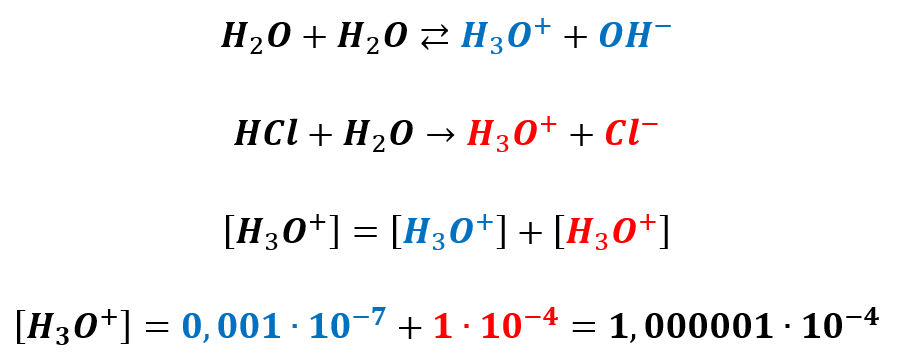
Dlaczego 1,000001·10-4 zamiast 1,001·10-4? Dlaczego stężenie niebieskich protonów, czyli tych pochodzących z autodysocjacji wody jest 1000 razy mniejsze niż się spodziewamy? Bo dodatek mocnego kwasu przesunął równowagę dysocjacji wody w lewo. Stężenie tych jonów spadło aż 1000 razy i 1000 razy zmniejszył się stopień dysocjacji wody! Dlatego pOH tego roztworu wynosi 10…
Zresztą pomyślmy: dlaczego pH roztworu KOH o stężeniu 0,1 mol/dm3 wynosi 13? Bo stężenie kationów wodoru z autodysocjacji wody jest 10-13, a nie 10-7 mol/dm3! No ludzie…
To, co mnie jednak najbardziej przeraża, to fakt, że takie błędy, które może popełniać na pewnym etapie licealista – popełniają osoby odpowiedzialne za ocenianie prac konkursowych, na przykład w Wielkopolskiej Superlidze Liceów, jak ostatnio ktoś dał mi Zn… Smutne to.
Ale to nie jest jedyny taki przykład, bo dosłownie wczoraj (18.12.23) miał miejsce etap szkolny Podlaskiego Konkursu Chemicznego (i tutaj takze dziękuję za informację o tym. A oto jak organizatorzy widzą rozwiązanie pewnego zadania:

Takie rozwiązanie jest oczywiście nieprawidłowe, a wynik, choć podany z żądaną „dokładnością” – nie jest prawdziwy.
Na koniec muszę dodać, czy takie rozwiązanie stosowane na przykład przez vademeca i podręczniki szkolne (oraz przez organizatorów niektórych konkursów) ujdzie na maturze? NIE. Bo maturzysta ma wiedzieć, że dysocjacja wody jest procesem odwracalnym i co z tego wynika.
A ile wynosi pH roztworów wodorotlenku potasu o stężeniu 10-7 i 10-8 mol/dm3? 7,209 i 7,022. Spróbujcie dojść do tych wartości 😊
Pozdrawiam,
Damian Mickiewicz
Jeśli zależy Ci na bardzo dobrym wyniku na maturze, to zachęcam do skorzystania z serii lekcji Zadania maturalne bez tajemnic. Podczas tych lekcji omawiam zagadnienia wymagane na maturze i pokazuję jak rozwiązywać zadania, by nie popełnić błędów. Dodatkowo otrzymasz prezentacje, zadania maturalne, a nawet moje książki w formie PDF. Szczegóły TUTAJ




Brak komentarzy