
05 lut Matura: dysocjacja i hydroliza
Wiele osób twierdzi, że dysocjacja i hydroliza to osobne zjawiska. A TO NIEPRAWDA. I najważniejsza kwestia: a co na to matura?
Dysocjacja elektrolityczna, bo na niej się skupimy, to pojęcie trochę szersze, niż zwykle myślimy i może oznaczać różne procesy. Sama dysocjacja nie musi wiązać się z jonami, dlatego że są różne rodzaje dysocjacji. Mówiąc więc ściślej, skupimy się na dysocjacji elektrolitycznej, bo taka nas do matury interesuje, a słowo dysocjacja ma szersze znaczenie niż to, o którym uczymy się w szkole. Często słyszymy powtarzane z uporem maniaka, że to rozpad na jony. Czy wymagany zakres materiału szkolnego upoważnia nas do takiego wniosku? Spójrzmy.
1) Dysocjacja elektrolityczna może oznaczać rozpad związku jonowego na jony w jego roztworze:
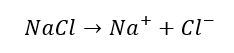
2) Dysocjacja elektrolityczna może oznaczać reakcję dwóch kowalencyjnych związków, w której produktem są jony, np: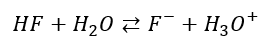
HF w wodzie ulega dysocjacji kwasowej, a równowagę dysocjacji opisuje Ka.
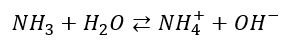
NH3 w wodzie ulega dysocjacji zasadowej, a równowagę dysocjacji opisuje Kb. Zauważmy, że rozpuszczalnik, w tym przypadku woda, bierze udział w dysocjacji, bo jest jej substratem.
3) Ale to nie wszystko! Dysocjacja elektrolityczna to także reakcja pomiędzy jonem a rozpuszczalnikiem, w wyniku czego powstają inne jony lub cząsteczki i jony, np.
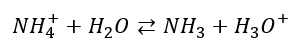
Jest to dysocjacja kwasowa jonu amonowego. Stałą równowagi tego procesu opisuje Ka. Tę dysocjację nazywamy także hydrolizą kationową.
Dysocjacja zasadowa jonu octanowego:
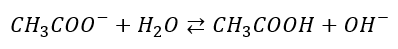
Stałą równowagi opisuje Kb. Tę dysocjację nazywamy także hydrolizą anionową.
NIE jest prawdą, że woda bierze udział w hydrolizie, a w dysocjacji nie – a tyle osób powtarza to bez żadnej refleksji nad jego sensem. Woda bierze udział w dysocjacji kwasów i zasad, czyli także w hydrolizie kationowej i anionowej. Nie musi brać udziału w dysocjacji soli, ale już w procesach wtórnych: dysocjacji produktów pierwszego etapu (dysocjacja kwasowa lub zasadowa, np. w wodnym roztworze Na2CO3). Zauważ, że teoria Broensteda-Lowry’ego mówi o dysocjacji kwasów i zasad. Sprzężone pary kwas-zasada wskażemy nie tylko w procesie CH3COOH + H2O, ale także w procesie CH3COO– + H2O – w jednym i w drugim przypadku jest to dysocjacja. Teoria ta nie dzieli procesów na dysocjację i hydrolizę, tylko mówi po prostu o dysocjacji! Zauważ także, że zachowanie zarówno NH3 jak i CO32- w wodzie określa ta sama stała: Kb, czyli stała dysocjacji, pomimo, że w przypadku anionu węglanowego to hydroliza! Więc hydroliza jest dysocjacją, czy nie? Analogicznie z HF i NH4+ – hydrolizę jonu amonowego opisuje stała dysocjacji!
Dlaczego tyle osób błędnie oddziela dysocjację od hydrolizy kationowej lub anionowej?
Ze względu na niedopowiedzenia. Jest dla nas oczywiste jak w wodzie dysocjuje CH3COOH, (bo że to kwas, to wiemy już z nazwy, nawiązującej właśnie do jego charakteru w wodzie), więc mówimy z przyzwyczajenia: dysocjacja. Ale konkretnie jest to dysocjacja kwasowa. Ale ktoś, kto nie znałby nazwy ani właściwości tego związku, na polecenie: „napisz dysocjację CH3COOH w wodzie” ma pełne prawa zapytać: ale zasadowej czy kwasowej? Czyli czy dany związek jest w wodzie kwasem czy zasadą. A co w przypadku fenolu albo amoniaku? Czy sama nazwa mówiła nam jak to się zachowuje w wodzie czy musieli nam to powiedzieć? Dziś możemy być mądrzy i pewne rzeczy być dla nas oczywiste. To ja powiem: „zapisz równanie dysocjacji nitroetanu w wodzie” – ilu z nas napisze równanie dysocjacji tego związku nitroetanu nie mając podanej informacji, czy związek ten jest kwasem czy zasadą w wodzie? Czyli czy ulega dysocjacji kwasowej, czy zasadowej? Niewielu. W wielu przypadkach sama nazwa nic nam nie powie, więc potrzebujemy wiedzieć, czy związek ulega dysocjacji kwasowej, czy zasadowej. Ale właśnie takie przyzwyczajenie się, że „kwas octowy ulega dysocjacji, a anion octanowy hydrolizie” – bez precyzowania, że chodzi o dysocjację kwasową (co dla nas oczywiste z racji nazwy: kwas) powoduje powielanie tego pospolitego błędu i traktowanie dysocjacji i hydrolizy jako osobne procesy.
A co matura na nazwanie hydrolizy dysocjacją?
Zadania maturalne precyzują, o jaki typ dysocjacji chodzi. Spójrzmy na polecenie do zadania 27 z maja 2020 roku:

Ale szczególną uwagę zwróćmy na informację do zadań jak i na treści poleceń, np. zadania 10 – 12 z maja 2017 roku:


Chodźmy o krok dalej. Zadanie 12 z maja 2018. Dlaczego w odpowiedziach pojawia się podkreślona odpowiedź?!


Skąd taka dla wielu osób zaskakująca odpowiedź jest przykładem poprawnej? Bo może. To prawidłowa odpowiedź, a hydroliza w roztworach soli to też dysocjacja. Odróżnianie hydrolizy od dysocjacji i stwierdzenia typu: „pamiętaj, że w hydrolizie bierze udział woda, a w dysocjacji nie” – są błędne. Podobnie, jak i stwierdzenia typu: „Anion węglanowy w wodzie nie dysocjuje, tylko hydrolizuje” – bo nie dysocjuje przez odszczepienie protonu, ale dysocjuje jako zasada – z przyjęciem protonu. Nie dysocjuje w takim sensie, jak zwykle skrzywieni przez niedopowiedzenie myślimy o dysocjacji: że to tylko odszczepienie protonu, ale jego przyjęcie przez anion już nie. Poprawnie powiemy: anion węglanowy dysocjuje w wodzie jako zasada, ale nie jako kwas lub anion węglanowy ulega w wodzie dysocjacji zasadowej, ale nie kwasowej, albo że anion węglanowy ulega w wodzie hydrolizie anionowej, ale nie dysocjacji kwasowej.
Pamiętaj, że matura nie tworzy własnych pojęć, tylko korzysta z ogólnych umów świata chemików. Zatem na maturze możesz napisać, że anion octanowy ulega dysocjacji zasadowej, zamiast ulega hydrolizie/hydrolizie anionowej. Możesz także napisać, że anion octanowy ulega hydrolizie anionowej, dysocjacji zasadowej lub po prostu reakcji z wodą 😊. Pamiętaj tylko o precyzyjnym wyrażaniu się – to najważniejsze przy pisaniu odpowiedzi w zadaniach otwartych! 😊
A na koniec wyjaśnijmy sobie jeszcze jedną kwestię. Często się mówi, że np. octan sodu dysocjuje, a anion octanowy hydrolizuje. A jak to jest doprecyzowując? W przypadku octanu sodu mamy do czynienia z dwoma procesami następczymi, będące w gruncie rzeczy dysocjacją. Pierwszy proces dysocjacji polega na rozpadzie soli na jony pod wpływem wody:
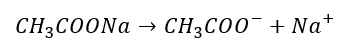
Kolejny etap to dysocjacja zasadowa anionów octanowych, czyli hydroliza:
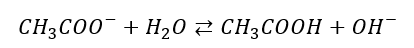
Mamy tutaj więc etapową dysocjację, podobnie jak w roztworze H2SO4. Zwróćmy uwagę, że w drugim etapie dysocjacji w akcie procesu bierze udział jon HSO4– i cząsteczka wody. Jon i cząsteczka, a produktami są wyłącznie jony. To samo dzieje się w akcie dysocjacji anionu octanowego: jon i cząsteczka dają dwa jony. Zmienia się za to rola wody: w dysocjacji HSO4– jest zasadą, w dysocjacji CH3COO– jest kwasem. Zasadnicza różnica pomiędzy dysocjacją H2SO4 i CH3COONa jest taka, że w pierwszym etapie mamy do czynienia z różnego typu dysocjacją: rozpadem związku jonowego na jony pod wpływem wody w przypadku CH3COONa i reakcją H2SO4 z wodą w przypadku H2SO4.
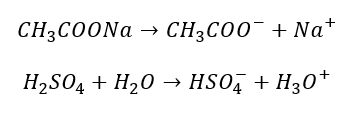
PS słowo hydroliza ma też inne znaczenia, ale artykuł dotyczy akurat równowag w roztworach elektrolitów 😊
Pozdrawiam,
Damian Mickiewicz
Jeśli zależy Ci na bardzo dobrym wyniku na maturze, to zachęcam do skorzystania z Pakietu MAX 2.0. W kursie omawiam zagadnienia wymagane na maturze i pokazuję jak rozwiązywać zadania. Dodatkowo otrzymasz mnóstwo cennych materiałów takich jak nagrania z lekcji, prezentacje, notatki, zadania maturalne, a nawet moje książki w formie PDF. Szczegóły TUTAJ




Brak komentarzy